Acesso
Preencha o login e senha para cadastrar uma nova pesquisa clínica ou para editar os dados de uma nova pesquisa já inserida.
São permitidos apenas um login e senha por instituição.
Acesso
Associado(a), por favor utilize seu CPF cadastrado na SBOC. Caso não se lembre ou não tenha cadastrado antes, entre em contato pelo e-mail [email protected].

Multiprofissional
Equipe Grano
A Sociedade Brasileira de Oncologia Clínica (SBOC) é uma das 17 instituições da área da saúde integrante do Grupo de Trabalho Intersetorial de Vacinação do Adulto e do Idoso (VAI). Os objetivos desta iniciativa são conscientizar a população sobre a importância da vacinação além da infância e adolescência e desenvolver ações educativas para médicos e profissionais da saúde.
A mobilização em prol da imunização tem especial relevância na medida em que o Brasil passa por um significativo processo de envelhecimento populacional. De acordo com o último Censo do Instituto Brasileiro de Geografia e Estatística (IBGE), de 2022, as pessoas com 60 anos ou mais representam 15,6% da população – uma alta de 56% em relação a 2010. Em contrapartida, a população até 14 anos caiu de 24,1% para 19,8%.
Nesse cenário, é necessário ressaltar que pessoas de idade avançada tendem a ser mais vulneráveis a infecções que podem causar desfechos graves e levar ao declínio funcional, cognitivo ou perda da autonomia. Adultos e idosos imunodeprimidos ou com doenças de base – como diabetes, cardiopatias e câncer – correm mais risco de complicações.
Segundo a coordenadora do Guia de Vacinação no Paciente Oncológico da SBOC – realizado em parceria com a Sociedade Brasileira de Imunizações (SBIm) –, Dra. Maria Ignez Braghiroli, a vacinação protege pacientes oncológicos, que muitas vezes têm a imunidade comprometida. “Vacinar é um ato de cuidado e prevenção”, reitera a oncologista clínica.
Além disso, trata-se de um ato social importante: quem se vacina contribui para uma sociedade mais saudável, ao reduzir o risco de transmissão, o que ajuda a controlar surtos e a proteger comunidades inteiras. Por fim, as vacinas são investimentos inteligentes: os benefícios superam os custos diminuindo internações e reduzir gastos diretos e indiretos com saúde.
A campanha também se direciona aos médicos. A estimativa é de que 80% dos pacientes que recebem prescrição profissional se vacine. Por isso, o grupo incentiva que todos os profissionais prescreveram as imunizações necessárias a seus pacientes e promovam a segurança e eficácia das vacinas.
Além da SBOC, fazem parte do GTI-VAI as Sociedades Brasileiras de Cardiologia, de Cirurgia Oncológica, de Dermatologia, de Diabetes, de Geriatria e Gerontologia, de Genética Médica, de Infectologia, de Imunizações, de Pneumologia e Tisiologia, de Reumatologia, de Transplante de Médula Óssea e de Urologia; das Associações Brasileiras de Transplante de Órgãos e de Alergia e Imunologia; da Federação Brasileira das Associações de Ginecologia e Obstetrícia; e do Conselho Nacional de Secretários de Saúde. O grupo também conta com apoio do Departamento do Programa Nacional de Imunizações e do Conselho Nacional de Secretarias Municipais de Saúde.
Oncologista clínico - Anápolis (GO)
Oportunidades para profissionais da oncologia Quinta, 26 Fevereiro 2026 18:27A Santa Casa de Misericórdia de Anápolis, em Goiás, está com vaga aberta para um oncologista clínico.
São requisitos obrigatórios residência e Título de Especialista em oncologia clínica, entre outros.
Interessados devem entrar em contato via Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo..
Folha de S.Paulo: Dados do Inca mostram que mulheres serão maioria nos casos de câncer de tireoide
SBOC na Mídia Quarta, 25 Fevereiro 2026 15:25Folha de S.Paulo: Dados do Inca mostram que mulheres serão maioria nos casos de câncer de tireoide; SBOC comenta
A Folha de S.Paulo publicou reportagem sobre o aumento da incidência de câncer de tireoide no Brasil, com base nas estimativas do Instituto Nacional do Câncer (Inca) para o triênio 2026– 2028. Segundo os dados apresentados, são esperados 13.310 novos casos anuais entre mulheres e 3.140 entre homens, evidenciando uma proporção média de quatro diagnósticos femininos para cada caso masculino. A matéria destacou a participação da Sociedade Brasileira de Oncologia Clínica (SBOC) na análise do cenário epidemiológico e na contextualização das informações para o público.
A reportagem ouviu a Coordenadora do Comitê de Tumores de Cabeça e Pescoço da SBOC, Dra. Aline Lauda, que explicou que fatores hormonais e a maior procura das mulheres por exames contribuem para a maior incidência da doença nesse público. A especialista também ressaltou que, apesar de ser o quinto câncer mais frequente entre brasileiras, o câncer de tireoide apresenta alto índice de cura e, na maioria dos casos, comportamento pouco agressivo, não havendo indicação de rastreamento populacional amplo, exceto em situações específicas. “A mulher procura mais diagnóstico, faz mais exames e se cuida mais. É muito comum você ir ao ginecologista e ele pedir um ultrassom de tireoide”, afirmou.
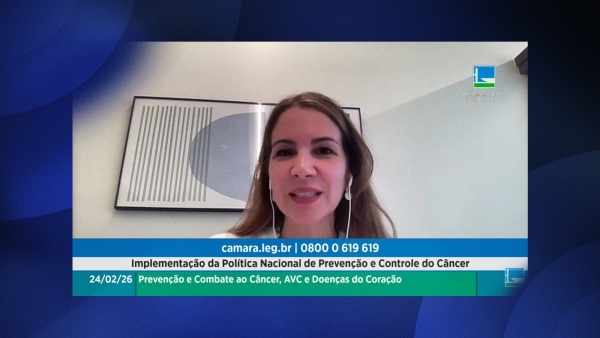
Presidente da SBOC defende fortalecimento de prevenção e diagnóstico precoce em audiência no Congresso
Notícias Terça, 24 Fevereiro 2026 21:01Em audiência pública realizada nesta terça-feira (24) na Câmara dos Deputados, a Presidente da Sociedade Brasileira de Oncologia Clínica (SBOC), Dra. Clarissa Baldotto, destacou a importância da Política Nacional de Prevenção e Controle do Câncer como forma de prevenção e diagnóstico precoce do câncer no país.
Dra. Clarissa lembrou os presentes que o controle do câncer no país não é apenas uma questão biológica, mas também social e ligada ao estilo de vida. Ao citar as estimativas recentes do Instituto Nacional de Câncer (INCA), que foram apresentadas no encontro, a presidente da SBOC demonstrou preocupação com o aumento de casos de câncer colorretal entre adultos jovens e a necessidade de combate a novas formas de tabagismo.
“Precisamos começar a pensar no rastreamento, que é feito com colonoscopia, com mais detalhes. Além disso, essa é uma doença que precisa de modificações no estilo de vida, então políticas de alimentação e nutrição nos servem não apenas para tratar pacientes e sobreviventes, mas como forma importante de prevenção”, declarou a oncologista clínica.
Um dos pontos centrais da participação da Presidente da SBOC foi o desafio econômico da oncologia moderna. Dra. Clarissa explicou que, nos últimos 20 anos, houve um avanço exponencial em medicamentos imuno e quimioterápicos, mas com custos igualmente elevados.
Para auxiliar autoridades na tomada de decisões sobre o que deve ser priorizado na incorporação nas redes pública e privada, a SBOC desenvolveu o Índice de Priorização de Medicamentos.
“Esse é um desafio no mundo inteiro e no Brasil o impacto pode ser ainda maior. No Índice, temos uma série de critérios para indicar quais medicamentos teriam impacto mais imediato e precisariam mais rapidamente serem incorporados no Sistema Único de Saúde e na rede privada”, introduziu. “Muitas vezes, escolhas precisam ser feitas e, por isso, estamos trabalhando juntamente com o Ministério da Saúde”, completou.
Entre outros pontos, Dra. Clarissa também corroborou a importância das políticas de navegação, que funcionam como um guia para o paciente ao longo da jornada de tratamento.
Na sua visão, a organização desses fluxos pode encurtar o tempo de diagnóstico e evitar o desperdício de recursos públicos. “Temos um comitê técnico multidisciplinar que vem trabalhando no treinamento de navegadores e em políticas de navegação. Precisamos trabalhar esta parte da Política Nacional de Prevenção e Controle do Câncer com prioridade”, disse.
A audiência pública foi convocada por uma comissão especial da Câmara dos Deputados criada para acompanhar as ações de combate ao câncer no Brasil. O encontro foi realizado a pedido do deputado Weliton Prado como forma de acompanhar as mais recentes iniciativas do Ministério da Saúde e do INCA nesse âmbito. "É urgente conhecer as ações que estão sendo feitas para uma efetiva aplicação da Política aos usuários do Sistema Único de Saúde. A prevenção e o diagnóstico precoce são os melhores remédios contra a doença", declarou.
Oncologista Clínico - Franco da Rocha (SP)
Oportunidades para profissionais da oncologia Quinta, 12 Fevereiro 2026 17:11O Grupo Instituto do Câncer Brasil (ICB) está com oportunidade aberta para oncologistas clínicos interessados em atuar no Hospital Estadual Doutor Albano da Franca Rocha Sobrinho, em Franco da Rocha (SP), de terça-feira e sexta-feira.
A remuneração é competitiva, acima da média de mercado, com possibilidade de crescimento profissional em um ambiente multiprofissional e colaborativo.
Interessados devem entrar em contato com o Dr. Eduardo Zucca pelo WhatsApp (12) 99670-6805 ou pelo e-mail Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo..
SBOC participa de discussão sobre nova APAC de medicamentos oncológicos
Notícias Terça, 10 Fevereiro 2026 20:46A SBOC esteve representada hoje, 10, na Oficina de Discussão da Nova Autorização de Procedimento Ambulatorial de Alta Complexidade (APAC), por Dr. Clarissa Baldotto, Dra. Angélica Nogueira e Dra. Marisa Madi, respectivamente Presidente, Presidente de Honra e Diretora Executiva da entidade. O encontro aconteceu no Auditório da Agência de Apoio à Gestão do Sistema Único de Saúde (AgSUS) e girou em torno da definição do processo da nova APAC de medicamentos oncológicos de alto custo, em consonância com o Componente de Assistência Farmacêutica em Oncologia (AF-ONCO).
Também foram discutidas a organização do acesso, da aquisição e da dispensação das terapias, visando maior equidade, transparência e eficiência na gestão. Por fim, foi pauta a inclusão de medicamentos de doenças raras e oncológicos para população infanto-juvenil.
Para Dra. Clarissa Baldotto, a SBOC tem muito a contribuir com o seu quadro de especialistas, visto que a APAC está se tornando mais técnica, facilitando a entrada de informações tanto para o prescritor, quanto para o gestor que está auditando. Em seu entendimento, a nova APAC ajudará muito na incorporação e na adequação aos Protocolos Clínicos e Diretrizes Terapêuticas (PCDT) do Ministério da Saúde.
“Com todas essas mudanças, o que vai impactar de verdade vai ser o dia a dia dos pacientes. Acreditamos que eles irão ter acesso, em tempo mais ágil, a toda a incorporação tecnológica e os avanços que a oncologia clínica vem passando nos últimos anos”, adicionou a Presidente da SBOC.
Dra. Clarissa Baldotto compôs a mesa de abertura do evento ao lado do Secretário de Atenção Especializada à Saúde, Dr. Mozart Sales, da recém-nomeada Diretora do Departamento de Atenção ao Câncer do Ministério da Saúde e associada SBOC, Dra. Guacyra Pires, do Coordenador de Assistência do Instituto Nacional de Câncer (INCA), Dr. Gélcio Luiz Quintella Mendes, e do Diretor da AgSUS, Dr. André Longo.
Dra. Guacyra Magalhães Bezerra assume o Departamento de Atenção ao Câncer do Ministério da Saúde
Notícias Sábado, 07 Fevereiro 2026 16:11A oncologista clínica Dra. Guacyra Magalhães Pires Bezerra é a nova Diretora do Departamento de Atenção ao Câncer – órgão vinculado à Secretaria de Atenção Especializada à Saúde (SAES) do Ministério da Saúde e responsável pela coordenação da Política Nacional de Prevenção e Controle do Câncer (CGCAN). A função era ocupada até então pelo também oncologista clínico Dr. José Barreto Campello Carvalheira.
Associada da Sociedade Brasileira de Oncologia Clínica (SBOC) desde 2010, Dra. Guacyra graduou-se em Medicina pela Universidade Federal da Paraíba (UFPB), fez residência em Clínica Médica e Terapia Intensiva pelo Hospital Universitário Lauro Wanderley (UFPB) e em Oncologia Clínica pelo Hospital Universitário Oswaldo Cruz, da Universidade de Pernambuco (UPE).
Dra. Guacyra fez ainda MBA Executivo em Gestão da Saúde pela Faculdade Pernambucana de Saúde; mestrado em Patologia e doutorado em Medicina Tropical, ambos pela Universidade Federal de Pernambuco (UFPE).
Em sua trajetória profissional, atuou como oncologista clínica no Núcleo de Oncologia do Agreste (NOA), em Caruaru (PE); foi coordenadora do Serviço de Oncologia do Hospital Mestre Vitalino, presidente da Comissão de Cuidados Paliativos da instituição e preceptora da Residência de Clínica Médica na mesma instituição.
Dr. José Barreto deixa legado importante
Também associado à SBOC, o oncologista clínico Dr. José Barreto ficou à frente do Departamento de Atenção ao Câncer por aproximadamente 1 ano e sete meses.
Neste intervalo, houve progressos importantes, incluindo a atualização do Protocolo Clínico e Diretrizes Terapêuticas (PCDT) para câncer de mama e a inclusão de terapias avançadas como os inibidores de ciclina e o trastuzumabe entansina.
Destaca-se também a criação da Assistência Farmacêutica em Oncologia (AF-Onco), mecanismo que foi uma das frentes da reformulação da oncologia no Sistema Único de Saúde – iniciada com a instituição da Política Nacional de Prevenção e Controle do Câncer.
A iniciativa foi criada como estratégia do Executivo para organizar o acesso a medicamentos oncológicos, garantindo a integralidade do tratamento medicamentoso na atenção contra o câncer, com base nos PCDTs do Ministério da Saúde.
Veja Rio: Clarissa Baldotto: “Vivemos uma revolução no câncer”
SBOC na Mídia Quinta, 05 Fevereiro 2026 17:35A Presidente da SBOC, Dra. Clarissa Baldotto, publicou ontem, 4, Dia Mundial do Câncer, um artigo na coluna de Lu Lacerda, na Veja Rio. No texto, a especialista reflete sobre os avanços científicos na oncologia e os desafios para garantir que esses progressos cheguem a todos os pacientes. A médica destaca que a área vive uma das maiores revoluções da história da medicina, com terapias-alvo, imunoterapia e estratégias celulares avançadas que já ampliam a sobrevida e a qualidade de vida de muitos pacientes.
A publicação ressalta, porém, o dilema enfrentado pelo Brasil diante da incorporação de tecnologias sofisticadas, que exigem infraestrutura, equipes especializadas e medicamentos de alto custo, enquanto o número de casos cresce impulsionado pelo envelhecimento da população e por fatores ligados ao estilo de vida. Dra. Clarissa defende que a inovação deve caminhar junto à escuta, ao humanismo e à comunicação clara com pacientes, reforçando que não há tratamento de excelência sem vínculo, confiança e cuidado centrado na pessoa.
Ao abordar as prioridades de sua gestão à frente da SBOC, a presidente enfatiza a importância de fortalecer prevenção, diagnóstico precoce e organização das linhas de cuidado, além de defender a incorporação responsável de novas tecnologias com base em valor e benefício real. A oncologista também destaca que atrasos no início do tratamento impactam diretamente a vida dos pacientes e reforça o papel da comunicação como ferramenta de saúde pública. Ao final, defende que os avanços científicos na oncologia devem produzir equidade, garantindo acesso ao tratamento de qualidade, no tempo certo e com dignidade.
INCA projeta 781 mil novos casos de câncer por ano no Brasil para o triênio 2026-2028
Notícias Quarta, 04 Fevereiro 2026 19:02O cenário da oncologia no Brasil para os próximos anos revela um desafio de saúde pública de proporções crescentes, conforme aponta o relatório “Perfil Epidemiológico da Incidência de Câncer no Brasil e Regiões”, divulgado pelo Instituto Nacional de Câncer (INCA), nesta quarta-feira, 4 de fevereiro, em ocasião do Dia Mundial do Câncer.
As estimativas para o triênio 2026-2028 indicam que o país deve registrar 781 mil novos casos anuais da doença. Retirando desse cálculo o câncer de pele não melanoma – que possui alta incidência, mas baixa letalidade –, o volume total de novas ocorrências atinge a marca de 518 mil diagnósticos por ano. Esse montante se distribui de forma quase equilibrada entre os sexos, com 49,4% dos casos previstos em homens e 50,6% em mulheres.
De acordo com o INCA, o perfil da doença no Brasil é marcado pela predominância de seis tipos específicos de câncer, que juntos respondem por aproximadamente 65% de toda a carga de novos diagnósticos. Os tumores de mama feminina e de próstata continuam sendo as grandes prioridades, representando, cada um, cerca de 15% das ocorrências anuais. Logo atrás, o câncer de cólon e reto aparece como o terceiro mais frequente, com 10,4% dos casos, seguido pelos tumores de pulmão (6,8%), estômago (4,4%) e colo do útero (3,7%).
O relatório destaca duas tendências relevantes relacionadas ao envelhecimento populacional e à adoção de estilos de vida menos saudáveis, como alimentação rica em ultraprocessados, sedentarismo e consumo de tabaco: o aumento dos casos de câncer colorretal e de câncer de pulmão. Este, sobretudo, entre mulheres e populações jovens, refletindo o impacto do tabagismo e novas formas de consumo de nicotina.
Outro ponto crítico revelado pelo estudo é a profunda desigualdade regional no território brasileiro. Enquanto as regiões Sul e Sudeste apresentam um perfil de tumores mais associado ao envelhecimento e à urbanização, as regiões Norte e Nordeste ainda lidam com uma carga elevada de cânceres relacionados a causas infecciosas e vulnerabilidades sociais, como o câncer do colo do útero e o de estômago. No Amapá, por exemplo, o câncer de colo do útero chega a superar o de mama em incidência entre as mulheres.
Ex-presidente da SBOC (2003-05) e atual diretor do INCA, Dr. Roberto de Almeida Gil, ressaltou, durante cerimônia de lançamento do documento, que estes dados servirão para as autoridades sanitárias definirem as próximas prioridades e construírem novas políticas públicas em relação ao cuidado com o câncer no Brasil.
Estadão: O desafio de garantir que todos tenham as mesmas chances contra o câncer
SBOC na Mídia Quarta, 28 Janeiro 2026 19:34O Estadão publicou artigo de opinião intitulado “O desafio de garantir que todos tenham as mesmas chances contra o câncer”, que abordou de forma aprofundada as desigualdades estruturais no cuidado oncológico no Brasil, incluindo dimensões socioeconômicas, raciais, de gênero, identidade e orientação sexual. O texto destacou o Guia de Diversidade da Sociedade Brasileira de Oncologia Clínica (SBOC) como uma iniciativa central para apoiar oncologistas, equipes multiprofissionais e gestores na construção de um cuidado mais inclusivo, equitativo e baseado em evidências.
A matéria trouxe relatos e análises que evidenciam como o racismo estrutural, a exclusão da população LGBTQIAPN+ e a ausência de dados sistematizados impactam o acesso ao diagnóstico, o início oportuno do tratamento e os desfechos clínicos. Nesse contexto, o membro do Comitê Multiprofissional da SBOC, enfermeiro e pesquisador em oncologia Dr. Ricardo Souza Evangelista Sant’Ana afirmou: “A gente fala muito em oncologia personalizada, mas como fazer equidade se não perguntamos identidade de gênero e orientação sexual?”. O especialista ressaltou ainda que a falta de acolhimento e de escuta qualificada interfere diretamente nos resultados do cuidado, destacando que “as pessoas não se sentem acolhidas, e isso impacta os desfechos”.
Ao dar visibilidade ao Guia de Diversidade da SBOC e às falas de seus representantes, o artigo reforça o papel da Sociedade como referência nacional no debate sobre equidade em saúde e qualidade da assistência oncológica. A publicação contribui para ampliar o diálogo público sobre diversidade e inclusão na oncologia, posicionando a SBOC como agente ativo na formulação de soluções estruturantes para um cuidado oncológico mais justo no Brasil.









 Seja um
Seja um Agenda de
Agenda de  Pesquisa
Pesquisa Consensos e
Consensos e Biblioteca
Biblioteca 